AFFILIAZIONE
asl vco
AUTORE PRINCIPALE
Ing Garzotto Francesco
VALUTA IL CHALLENGE
GRUPPO DI LAVORO
Ing Garzotto Francesco – asl vco, verbania
Comoretto Irene – department of public health and pediatrics, university of turin, italy, torino
Dorigo Lorenzo – azienda zero, padova
Nalesso Federico – department of medicine, nephrology, dialysis and transplant unit, university of padua, padova, padova
AREA TEMATICA
Innovazione (processi, prodotti, servizi)
ABSTRACT
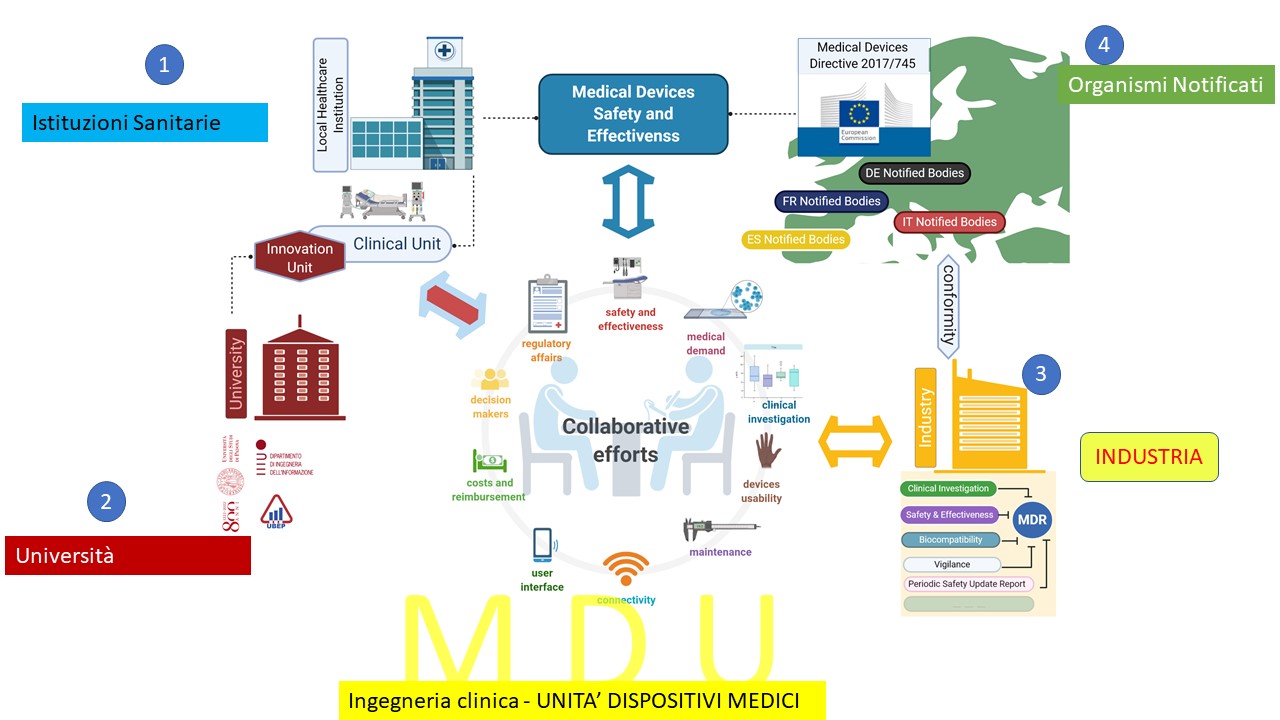
Il Regolamento sui Dispositivi Medici 2017/745 MDR(1) contiene molte disposizioni per un sistema focalizzato su indagini e valutazioni cliniche per assicurare efficacia e sicurezza in tutte le fasi di sviluppo ed utilizzo del dispositivo (2-5). Start-up e le PMI non sono grado di far fronte alla crescente complessità e cambiamenti di prospettiva (6). Le istituzioni sanitarie sono sotto pressione a causa dell’aumento della spesa e della mancanza di una valutazione sistematica di costo-efficacia. L’università non ha storicamente una grande efficienza nel trasferimento tecnologico in sanità ed è stata evidenziata una scarsità di funzioni di “matchmaking”, con pochi individui che hanno accesso sia alla facoltà clinica che a quella di ingegneria necessarie per creare le connessioni appropriate tra le discipline (7). Per supportare le crescenti attività cliniche, tecniche ed economiche richieste dalle normative MDR, 2021/2282 (HTA) e value based, è necessario istituire unità ospedaliere Medical Device Unit (MDU) gestite da Ingegneri Clinici: un punto facilitatore in cui “offerta e domanda” per l’industria, istituzioni sanitarie, organismi notificati ed il mondo accademico intersecano e soddisfano i loro bisogni. MDU deve includere/coinvolgere: medici per identificare gli outcome clinici; esperti in economia sanitaria; bioingegneri per valutazioni di usabilità, verifica/validazione, biocompatibilità, human factors, intelligenza artificiale, cybersecurity, analisi del rischio, normative; statistici per il disegno dello studio clinico. I dispositivi medici non sono farmaci e necessitano di specifiche conoscenze e disegni ad hoc (8-9).
Modelli di sanità “vaule based” (10) necessitano di favorire l’interoparabilità, la raccolta sistematica di evidenze cliniche derivanti da diverse tecnologie.
“Innovative Health Initiative”(14) identifica le barriere alle collaborazioni tra I diversi stakeholder e propone dei modelli di partnership pubblico-privato; MDU ne rappresenta la concretizzazione
La nostra esperienza ha consentito di collaborare con organismi notificati su valutazione di fascicoli tecnici, promuovere indagini cliniche (finalità MDR) in centri italiani su device prodotti
a Mirandola, stesura protocolli per COVID-19, controllo remoto di device per prevenire corss-contaminazioni, valutazioni di nuove tecnologie e disseminazione dei risultati. MDU garantisce opportunità di progresso nella sanità favorendo opportunità per tutti gli stakeholder.



